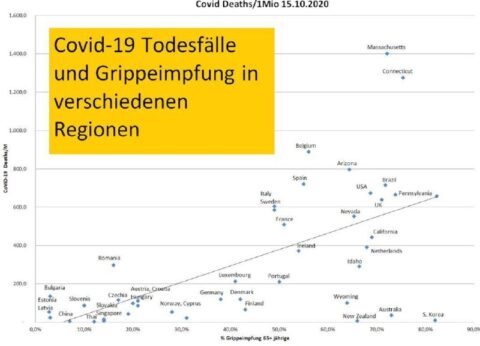
🔷BioNTechs / Pfizers Zulassungsantrag für eine Injektion gegen Omikron BA.4/BA.5 -Variante)🔷Auch hier: Geänderte Vorschriften zu Lasten der Arzneimittelsicherheit
Wie ich in meinem Post vom 27.8.2022 mitgeteilt hatte, haben BioNTech / Pfizer ausweislich BioNTechs Pressemitteilung vom 26.8.2022 den vollständigen Zulassungsantrag für die Zulassung einer bivalenten Injektion eingereicht. Bei dieser Injektion wird – wie von mir erwähnt – die 30 µg mRNA aufgeteilt auf
👉15 µg mRNA, die für das Spikeprotein der ursprünglichen Version des Coronavirus kodiert und
👉15 µg mRNA kodierend für das Spikeprotein der Omikronvarianten BA.4/ BA.5.
Aus arzneimittelrechtlicher / pharmazeutischer Sicht handelt es sich bei dieser Änderung um die Reduzierung der Stärke des ursprünglichen Wirkstoffs und um zusätzlich die Hinzufügung (mindestens) eines weiteren Wirkstoffs. Aus einem sog. “Monopräparat” mit einem Wirkstoff wird ein “Kombinationspräparat” mit mindestens 2 Wirkstoffen.
Üblicherweise würde eine solche gravierende Änderung als eine sog. “Zulassungserweiterung” klassifiziert werden mit der Folge, dass umfangreiche Unterlagen zur Qualität, Sicherheit und Wirksamkeit des Arzneimittels einzureichen wären. Es würde sich in einem solchen Fall NICHT um eine herkömmliche “Änderung der Zulassung” mit ggf. vereinfachtem Verfahren handeln. Die Regelungen hierzu finden sich in der Kommissions-Verordnung Nr. 1234/2008/EG in ihrer ursprünglichen Fassung.
Allerdings hat auch diese Verordnung im Jahr 2021 umfangreiche Änderungen im Zusammenhang mit der Änderung von Covid-19-Impfstoffen durch die Kommissions-Verordnung Nr. 2021/756/EG erfahren.
Die durch diese Verordnung eingeführten Änderungen erleichtern die Anpassung des Wirkstoffs der Covid-19-Injektionen im Hinblick auf den
“Austausch oder Hinzufügung …. einer kodierenden Region beziehungsweise einer Kombination von…. kodierenden Regionen bei einem Impfstoff gegen das humane Coronavirus“
sowohl im Hinblick auf die Klassifizierung als Typ II-Änderung als auch im Hinblick auf die vorzulegenden Unterlagen.
👉In Bezug auf die Klassifizierung wurden die eigentlich als Zulassungserweiterung zu klassifizierende Änderung des Wirkstoffs als Typ II-Änderung klassifiziert ( Anhang I Nr. 1c), Anhang II Nr. 2 lit. l) )
👉In Bezug auf ein mögliches Absehen erforderlicher Unterlagen zur Qualität, Präklinik und Klinik wurde Art. 21 der Verordnung neu gefasst und auf diese Weise eine der bedingten Zulassung nachempfundene Regelung für die Änderung der Zulassungen eingefügt:
“Bei Ausbrechen einer von der Weltgesundheitsorganisation oder von der EU im Rahmen des Beschlusses Nr. 1082/2013/EU des Europäischen Parlaments und des Rates (*) ordnungsgemäß festgestellten Pandemie durch das humane Influenzavirus oder das humane Coronavirus können die maßgeblichen Behörden, oder im Falle zentralisierter Zulassungen die Kommission, abweichend von den Kapiteln I, II, IIa und III eine Änderung der Zulassung eines Impfstoffs gegen das humane Influenzavirus oder das humane Coronavirus ausnahmsweise und vorläufig akzeptieren, auch wenn bestimmte pharmazeutische, nichtklinische oder klinische Daten fehlen.“
👆Wir haben hier also eine der bedingten Zulassung entsprechende Regelung ebenfalls bei der Zulassungserweiterung, die aber keine Zulassungserweiterung mehr ist, sondern per definitionem eine Typ II-Änderung und für die nicht einmal mehr die Unterlagen für eine Typ II-Änderung komplett vorgelegt werden müssen.
👉Schließlich wurde auch die Frist zum Erlass der Kommissionsentscheidung in diesen Fällen durch das Hinzufügen einer Ziffer ix) bei Art. 23 Abs. 1a der Verordnung auf 2 Monate nach Erhalt des Gutachtens des Ausschusses für Humanarzneimittel bestimmt.
Die Entscheidung der Kommission über eine solche als Typ II-Änderung klassifizierte Zulassungserweiterung kann daher schnell erlassen werden….
‼️... und das weiterhin / erneut zu Lasten der Arzneimittelsicherheit‼️
🔷Rechtsanwältin Dr. Brigitte Röhrig
Mein Telegram-Kanal: 👉 Klick
Rechtsanwältin Dr. Brigitte RöhrigWie ich in meinem Post vom 27.8.2022 mitgeteilt hatte, haben BioNTech / Pfizer ausweislich BioNTechs Pressemitteilung vom 26.8.2022 den vollständigen Zulassungsantrag für die Zulassung einer bivalenten Injektion eingereicht. Bei dieser Injektion wird – wie von mir erwähnt – die 30 µg mRNA aufgeteilt auf
👉15 µg mRNA, die für das Spikeprotein der ursprünglichen Version des Coronavirus kodiert und
👉15 µg mRNA kodierend für das Spikeprotein der Omikronvarianten BA.4/ BA.5.
Aus arzneimittelrechtlicher / pharmazeutischer Sicht handelt es sich bei dieser Änderung um die Reduzierung der Stärke des ursprünglichen Wirkstoffs und um zusätzlich die Hinzufügung (mindestens) eines weiteren Wirkstoffs. Aus einem sog. “Monopräparat” mit einem Wirkstoff wird ein “Kombinationspräparat” mit mindestens 2 Wirkstoffen.
Üblicherweise würde eine solche gravierende Änderung als eine sog. “Zulassungserweiterung” klassifiziert werden mit der Folge, dass umfangreiche Unterlagen zur Qualität, Sicherheit und Wirksamkeit des Arzneimittels einzureichen wären. Es würde sich in einem solchen Fall NICHT um eine herkömmliche “Änderung der Zulassung” mit ggf. vereinfachtem Verfahren handeln. Die Regelungen hierzu finden sich in der Kommissions-Verordnung Nr. 1234/2008/EG in ihrer ursprünglichen Fassung.
Allerdings hat auch diese Verordnung im Jahr 2021 umfangreiche Änderungen im Zusammenhang mit der Änderung von Covid-19-Impfstoffen durch die Kommissions-Verordnung Nr. 2021/756/EG erfahren.
Die durch diese Verordnung eingeführten Änderungen erleichtern die Anpassung des Wirkstoffs der Covid-19-Injektionen im Hinblick auf den
“Austausch oder Hinzufügung …. einer kodierenden Region beziehungsweise einer Kombination von…. kodierenden Regionen bei einem Impfstoff gegen das humane Coronavirus“
sowohl im Hinblick auf die Klassifizierung als Typ II-Änderung als auch im Hinblick auf die vorzulegenden Unterlagen.
👉In Bezug auf die Klassifizierung wurden die eigentlich als Zulassungserweiterung zu klassifizierende Änderung des Wirkstoffs als Typ II-Änderung klassifiziert ( Anhang I Nr. 1c), Anhang II Nr. 2 lit. l) )
👉In Bezug auf ein mögliches Absehen erforderlicher Unterlagen zur Qualität, Präklinik und Klinik wurde Art. 21 der Verordnung neu gefasst und auf diese Weise eine der bedingten Zulassung nachempfundene Regelung für die Änderung der Zulassungen eingefügt:
“Bei Ausbrechen einer von der Weltgesundheitsorganisation oder von der EU im Rahmen des Beschlusses Nr. 1082/2013/EU des Europäischen Parlaments und des Rates (*) ordnungsgemäß festgestellten Pandemie durch das humane Influenzavirus oder das humane Coronavirus können die maßgeblichen Behörden, oder im Falle zentralisierter Zulassungen die Kommission, abweichend von den Kapiteln I, II, IIa und III eine Änderung der Zulassung eines Impfstoffs gegen das humane Influenzavirus oder das humane Coronavirus ausnahmsweise und vorläufig akzeptieren, auch wenn bestimmte pharmazeutische, nichtklinische oder klinische Daten fehlen.“
👆Wir haben hier also eine der bedingten Zulassung entsprechende Regelung ebenfalls bei der Zulassungserweiterung, die aber keine Zulassungserweiterung mehr ist, sondern per definitionem eine Typ II-Änderung und für die nicht einmal mehr die Unterlagen für eine Typ II-Änderung komplett vorgelegt werden müssen.
👉Schließlich wurde auch die Frist zum Erlass der Kommissionsentscheidung in diesen Fällen durch das Hinzufügen einer Ziffer ix) bei Art. 23 Abs. 1a der Verordnung auf 2 Monate nach Erhalt des Gutachtens des Ausschusses für Humanarzneimittel bestimmt.
Die Entscheidung der Kommission über eine solche als Typ II-Änderung klassifizierte Zulassungserweiterung kann daher schnell erlassen werden….
‼️... und das weiterhin / erneut zu Lasten der Arzneimittelsicherheit‼️
🔷Rechtsanwältin Dr. Brigitte Röhrig
Mein Telegram-Kanal: 👉 Klick
🔷BioNTech / Pfizer vervollständigen ihren Zulassungsantrag für eine Injektion gegen Omikron BA.4/BA.5 -Variante als Auffrischungsdosis bei der Europäischen Arzneimittelagentur (EMA)🔷
Auf der Investorenseite der Webseite von BioNTech
https://investors.b…